
- EN
- CH



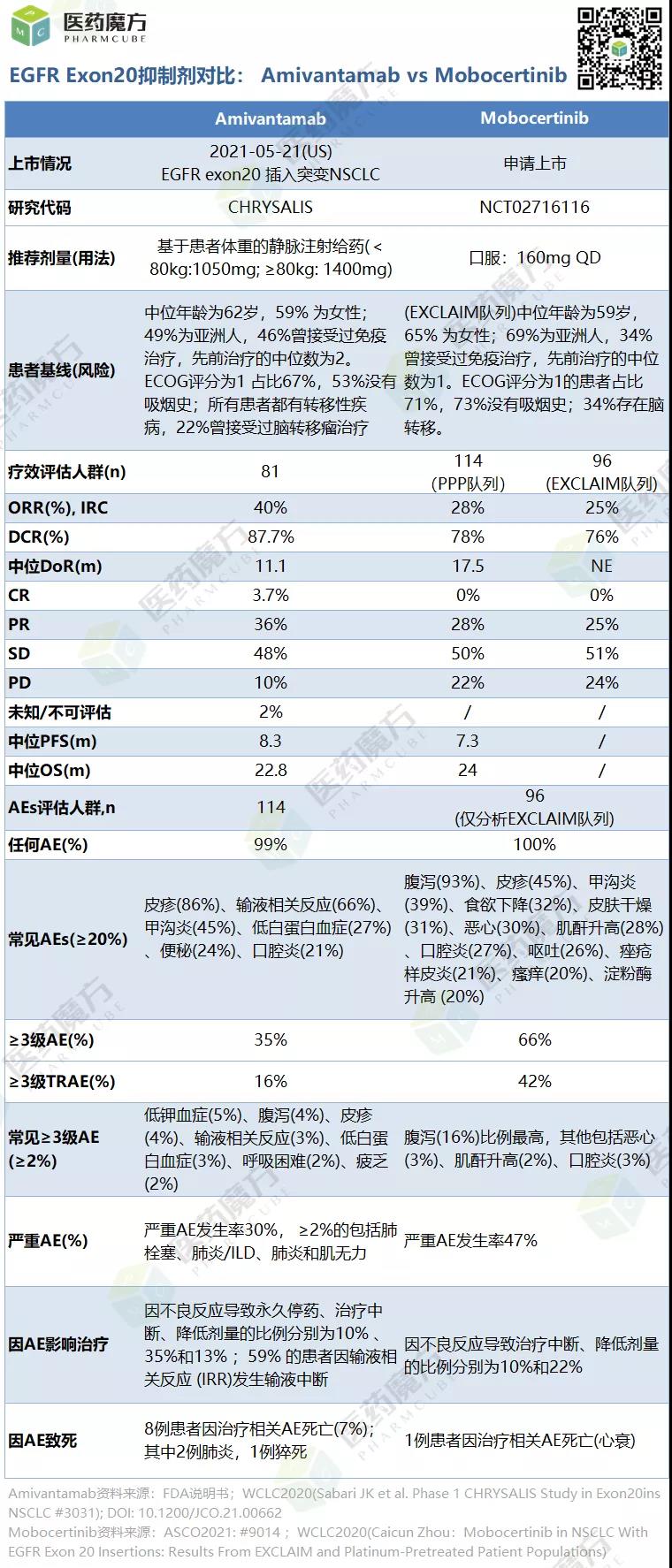
9月15日,武田宣布FDA加速批准Exkivity (mobocertinib) 上市,用于治疗携带EGFR 20号外显子插入突变并且接受铂类药物化疗后疾病进展的局部晚期或转移性非小细胞肺癌(NSCLC)成人患者。这是美国批准的首个针对EGFR Exon20插入突变的口服疗法。今年5月21日,针对同样的适应症,FDA加速批准了强生的EGFR/c-Met双抗Rybrevant (amivantamab-vmjw) 上市。
EGFR突变是非小细胞肺癌患者常见的基因突变,大约占到10%~15%,在亚洲人群中,这一数值大约为40%~50%。EGFR外显子20插入突变大约占到所有EGFR突变非小细胞肺癌患者的9%。EGFR外显子20插入突变的非小细胞肺癌患者通常对EGFR-TKI治疗不敏感,与更常见的EGFR突变(外显子19缺失/L858R替代)患者相比,预后更差。此前,该类患者的标准疗法为常规的细胞毒药物化疗。
正是基于无药可用的急迫局面,amivantamab凭借仅有81例患者的I期研究就获得FDA加速批准。与此类似,mobocertinib此次也是凭借一项小规模的I/II期临床试验(NCT0271611)的数据赢得了FDA批准。该结果在ASCO2021大会上公布,114例此前接受过铂类化疗且存在EGFR Exon20插入突变NSCLC患者纳入结果分析,经独立审查委员会评估,接受mobocertinib(160mg)每日1次治疗患者的客观缓解率为28%(研究者评估为35%),中位缓解持续时间(mDoR)为17.5个月,中位无进展生存期(mPFS)为7.3个月,疾病控制率为78%。
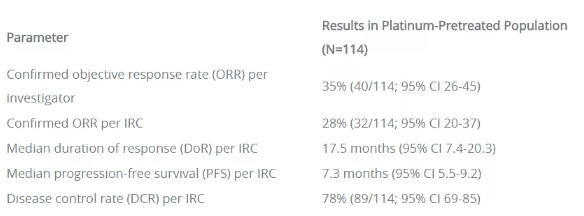
Mobocertinib的安全性可控,最常见的治疗相关不良事件(TRAEs)包括腹泻(90%)、皮疹(45%)、甲沟炎(34%)、恶心(32%)、食欲下降(32%)、皮肤干燥(30%)和呕吐(30%)。3级及以上TRAEs(≥5%)为腹泻(21%)。19例(17%)患者因AEs停药,最常见的导致停药AEs是腹泻(4%)和恶心(4%)。
Mobocertinib同时获得过FDA和CDE授予的突破性疗法资格。今年5月24日,CDE也受理了武田在中国基于该I/II期研究提交的新药上市申请,授予了优先审评资格。FDA此次通过Orbis程序对Mobocertinib的上市申请进行了审评,也意味着Mobocertinib很快将会迎来全球更多监管机构的批准。
(本文系转载,如有侵权,请联系删除。)

