
- EN
- CH



导读:2021年7月27日,国际人用药品注册技术协调会(ICH) Q13《原料药和制剂的连续制造指南》发布,正式进入内部咨询和公众评议阶段。
2019年2月,美国FDA 发布了《药品连续制造的质量考量》指南草案。FDA 这一指南比 ICH的指南覆盖面窄 , 只涉及固体口服小分子产品,而 ICH 的指南覆盖范围更广,涉及大分子和小分子产品。
2018年6月,ICH宣布将开始制定两个新的指南:分析程序开发和Q2(R1)分析方法验证的修订(Q14/Q2(R2)),连续制造(Q13)。
ICH 于 7 月 27 日正式发布了广受期待的 Q13 《原料药与制剂的连续制造指南》,公开征询意见。该指南“描述了药品连续制造(Continuous Manufacturing,CM)的开发、实施、操作和生命周期管理的科学和监管考虑因素”;还“澄清了 CM 的概念,描述了科学方法,并提出了针对原料药和制剂连续制造的监管考虑”。
该指南适用于化学实体和治疗性蛋白质原料药和制剂的连续制造;适用于新产品(例如,新药、仿制药和生物类似药)的连续制造以及现有产品从“批制造“转变为“连续制造”。指南中的原则也可能适用于其它生物/生物技术实体。
ICH Q13《原料药和制剂的连续制造指南》包括两部分:一个主体指南,五个附录组成。
第一部分,是关于药物成分和药品连续制造的科学和监管的基本考虑,包括:
指南的目的与范围
连续制造的概念(定义连续制造的模式,定义批)
科学方式的控制策略、在生产结果中的变化以及持续工艺确证
法规方面的考虑:工艺描述、控制策略、批描述、工艺描述、药物成分和药品的稳定性、从批生产转化为连续生产工艺、工艺验证、制药质量体系、生命周期管理、在CTD中提交连续制造的特定信息
术语
参考资料
第二部分,是由五个部分组成的附录:
连续制造的化学原料药:介绍及范例系统总览;控制策略及其它技术考虑(设备设计和完整性、过程监控、其它控制考虑、过程验证)、法规考虑
连续制造的药品制剂范例:介绍及范例系统总览;控制策略及其它技术考虑(物料性质及控制、设备设计和完整性、过程监控、过程验证)、法规考虑
连续制造的治疗用蛋白质药物成分范例:介绍及范例系统总览;控制策略(外来成分控制,设备设计和系统完整性、过程监督和实时放行检测)、工艺验证(方式、运行时间考虑、病毒清除验证)
综合的药物成分和药品的连续制造范例:介绍;综合的小分子药物成分和药品工艺(药物成分和药品工艺步骤的性质、综合工艺的范例、工艺设计和监控、启停、系统动力学的RTD性质及物料追踪性);质量标准和批数据(药物成分质量标准、药品质量标准、批数据);稳定性;在CTD中的药物成分和药品信息的位置
对干扰管理的期望(通过提供特定于某些模式、技术和生产方法的说明性示例和考量因素,用以补充指南正文。)
ICH Q13指南描述了三种不同的连续制造模式:
制造方法的组合,其中一些单元操作以批处理模式运行,而其它单元操作则集成并以连续模式运行;
原料药或制剂生产过程的所有单元操作被集成并以连续模式运行;
原料药和制剂单元操作跨越原料药和制剂之间的边界集成形成单一连续制造过程(即,原料药通过集成单元操作连续形成和加工以生成最终药品制剂)。
指南指出,在上述三种连续制造模式下的任何一种制造方法,都可以结合缓冲管线或储罐,保持物料输入和输出的恒定流量。
指南将 ICH Q7 的“批次”定义合并到连续制造中。“一批”被定义为由输出物料的量、输入物料的量或在定义的定义的质量流量下的运行时间组成。根据指南,其它“科学合理”的方法也被考虑用于定义“批次”。
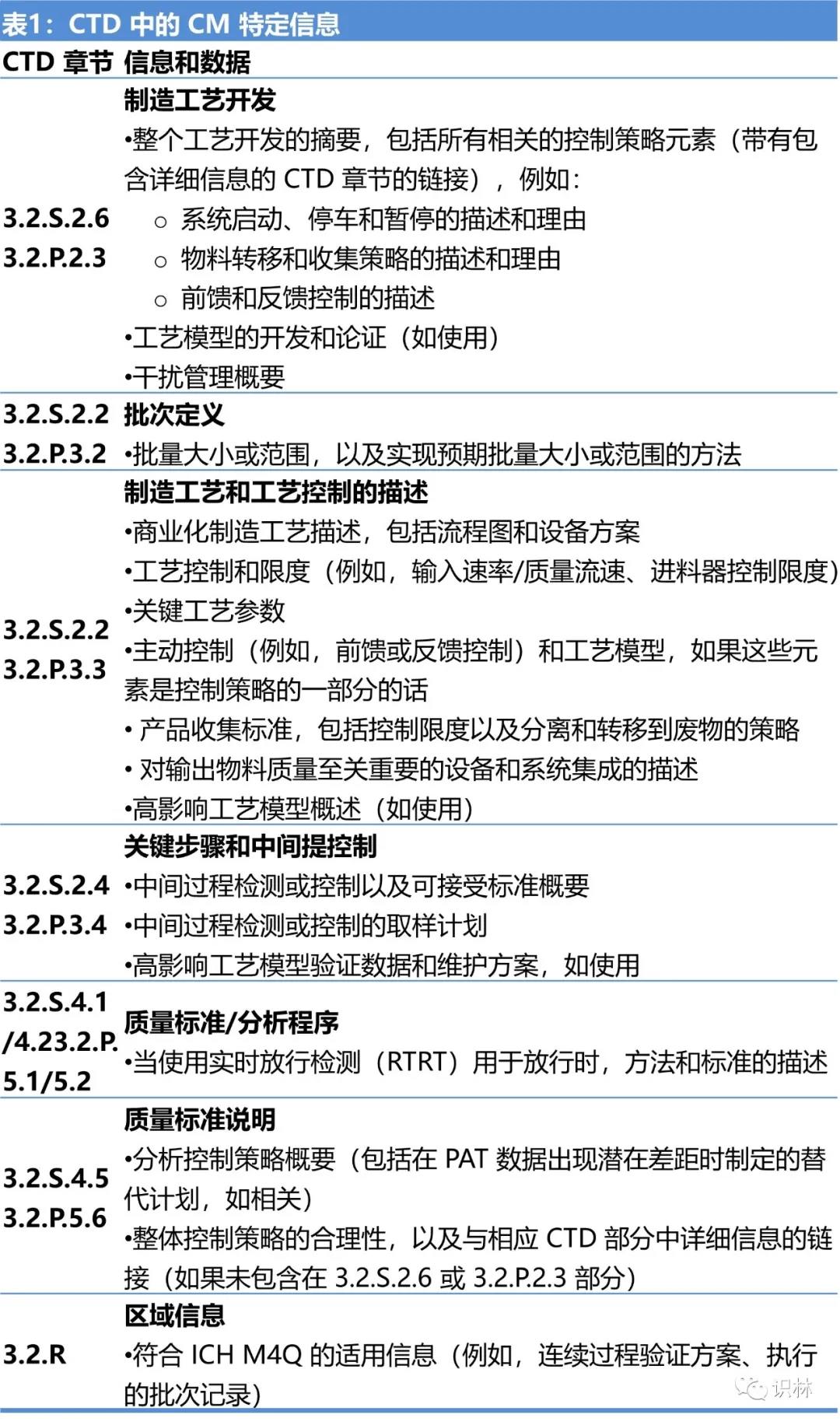
指南中还用一个章节介绍了在通用技术文件(CTD)中如何提交关于连续制造的特定信息,见表1。在原料药和制剂集成连续制造的情况下 , 一些信息和数据,例如集成流程图可能会在 CTD 3.2.P 中提供,并在 3.2.S 中交叉引用。
据介绍:ICH 专家工作组计划于 2021 年 11 月举行面对面会议 , 讨论收到的指南相关反馈意见,并计划于 2022 年 11 月签署文件,随后采纳、实施这一指南。
(本文系转载,如有侵权,请联系删除。)

